本記事では、GQPについて解説します。
Contents
GQPとは
GQPは、Good Quality Practiceの略で、自社の製造工場や委託先の製造業者に対し、適正な製造・品質管理を行っているかどうかを確認するために用いる基準のことをいいます。
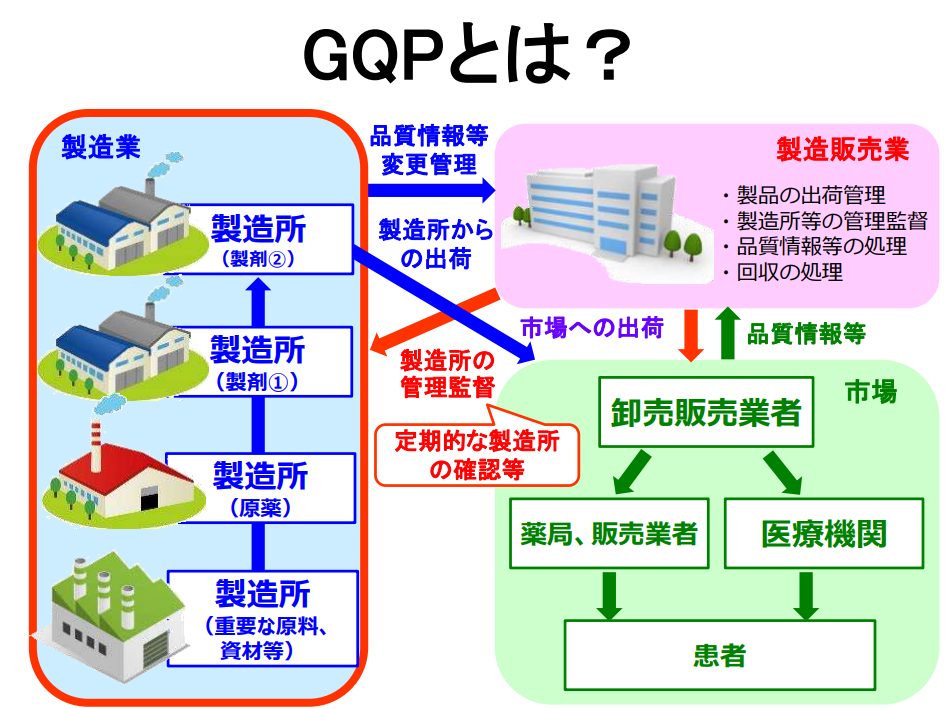
確認基準は次の通りです。
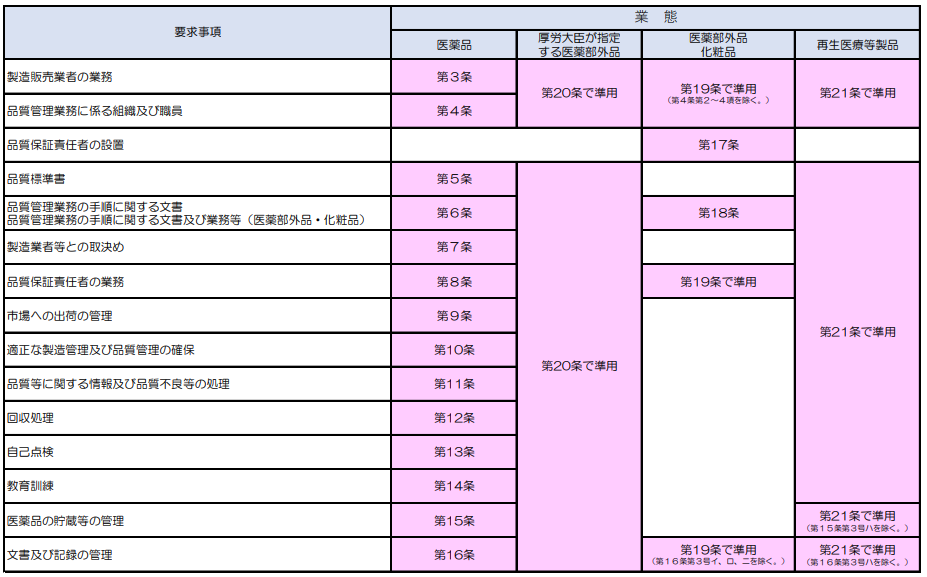
わかりづらいので、要求事項のみ抜き出します。
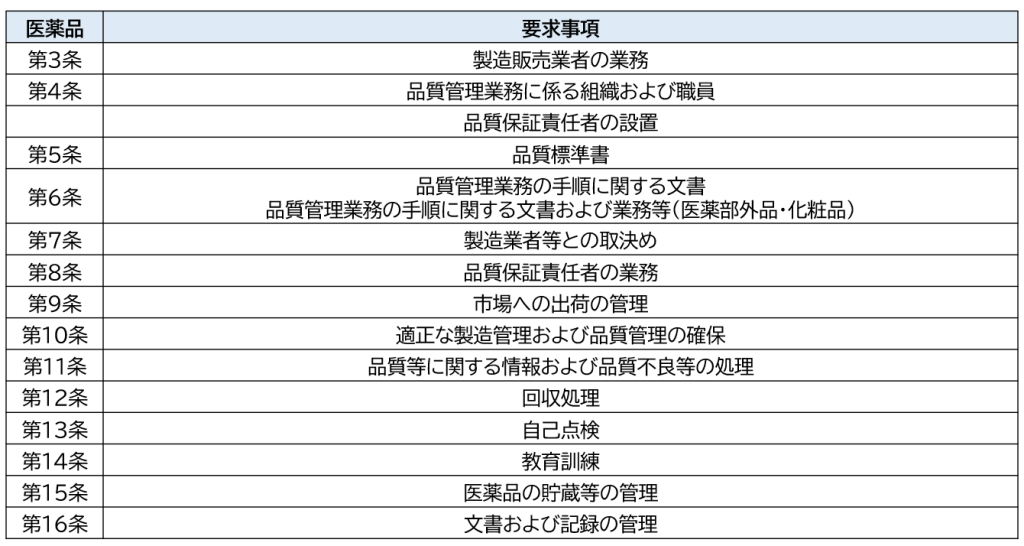
製造管理業務とは
製造販売を行うにあたり、必要な品質を確保するための業務を言います。
具体的には下記のとおりです。
- 市場への出荷管理
- 製造業者等に対する管理監督
- 品質等に関する情報および品質不良等の処理
- 回収処理
- その他、製品の品質管理に必要な業務
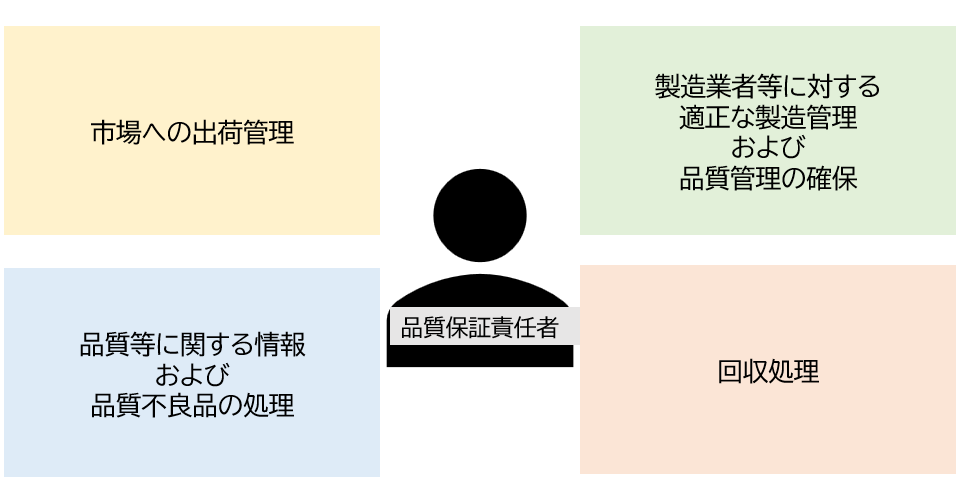
品質保証責任者とは
品質保証責任者は、次の業務を行う義務があります。
- 品質管理業務の統括
- 品質管理業務が適正かつ円滑に行われていることを「確認」すること
- 市場への出荷管理、適正な製造管理、品質管理の確保、品質等に関する情報・品質不良品の処理、これらの回収と自己点検に関して衣料品等総括製造販売責任者へ報告が義務付けられている事項のほか、品質管理業務遂行のために必要があると認められるときは、医薬品等総括製造販売責任者に文章で報告すること
- 回収、製造販売の停止等の品質管理業務の実施にあたり、必要に応じ、製造業者や販売業者、薬局開設者、病院、診療所の開設者、その他関係者に対して文書による連絡や指示を行うこと
品質標準書とは
医薬品の品目ごとに製造販売業者に作成が義務付けられている文書のことをいいます。
ただし、製造方法や手順については「製品標準書」ほど詳細な内容を記載する必要はなく、当該製造所等を管理監督するのに必要な情報が含まれていればOKとされています。
品質管理業務手順書の作成
総括製造販売責任者は、業務を行う事務所に品質標準書を備え付けなければならず、品質管理業務を行うその他の事務所には写しを備え付けなければなりません。
記載すべき内容は次の通りです。
- 市場への出荷管理に関する手順
- 適正な品質管理、製造管理の確保に関する手順
- 品質等に関する情報や不良品の処理に関する手順
- 回収処理に関する手順
- 自己点検に関する手順
- 教育訓練に関する手順
- 医薬品の貯蔵管理に関する手順
- 文書や記録管理に関する手順
- 安全管理統括部門や品質管理業務に関する部門・責任者との連携に関する手順
- その他品質管理業務を実施するために必要な手順
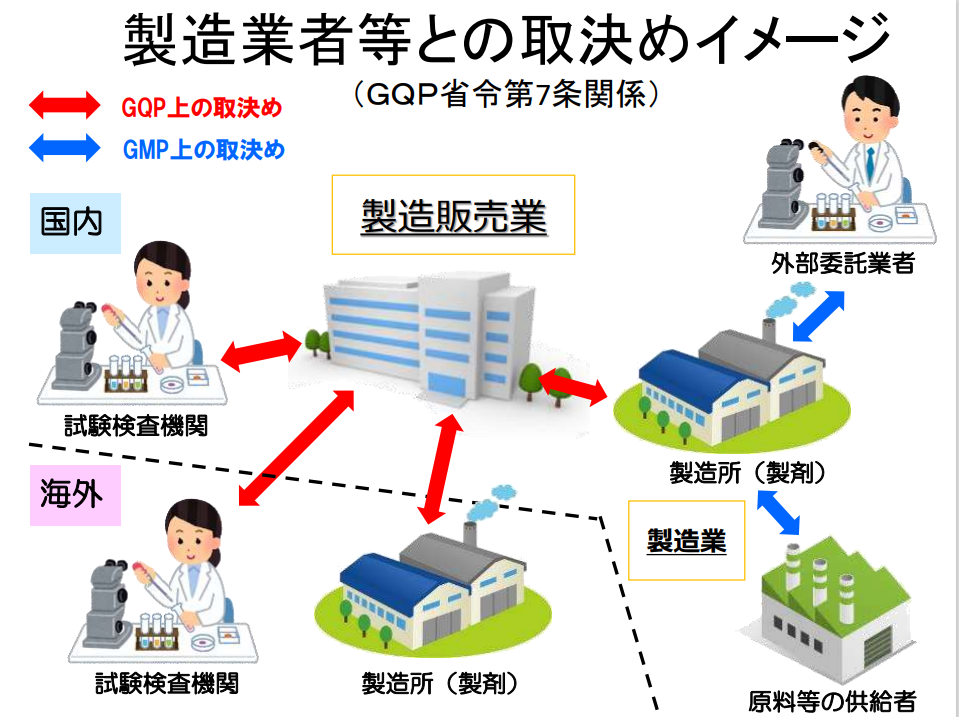
製造業者等との取決め
製造販売業者は、製品の製造業者等と次の事項を決め、品質管理業務手順書に記載する義務があります。
- 製造等の業務の範囲、製造管理や品質管理、出荷に関する手順
- 製造方法、試験検査方法に関する技術的条件
- 製造業務が適正かつ円滑な製造管理及び品質管理の下で行われていることについての製造販売業者による定期的な確認
- 製品の運搬や受け渡し時の品質管理方法
- 製造方法や試験検査方法の変更が品質に影響を及ぼす場合の製造販売業者への事前連絡の方法や責任者
- 次に掲げる情報についての製造販売業者への連絡方法や責任者
- 製造、輸入又は販売の中止、回収、破棄その他保健衛生上の危害の発生や拡大を防止するために講ぜられた措置に関する情報
- その他製品の品質に関する情報
- その他必要な事項
取決めの方法は、契約書本体で取決め内容を明らかにし、客観的に誰が見てもわかるような形式で行います。
市場への出荷の管理
製造販売業者は、品質管理業務手順書に基づき、市場への出荷の可否決定が適正かつ円滑に行えるようにする義務があります。
このため、出荷の可否決定を経ていない製品は、市場へ出荷できないことになります。
市場への出荷可否の決定は、ロットまたは製造番号ごとに行う必要があり、可否の結果と出荷先市場への出荷記録も必要です。
品質保証責任者以外の人が出荷の可否決定をする場合、決定者には市場への出荷の可否決定の結果を品質保証責任者に文書にて、適正に報告させる義務が生じます。
この際の注意点は、下記のとおりです。
- あらかじめ、製造業者と次の事項を取り決めること。
- イ 製造業者が行う市場への出荷の管理に関する手順
- ロ 出荷の可否決定の業務を行う者を、製造所の中からあらかじめ指定すること。
- ハ イに規定する手順からの逸脱等があった場合には、製造業者は速やかに品質保証責任者に対して文書により報告し、品質保証責任者の指示に基づき、市場への出荷の可否の決定及び市場への出荷を行います。
- ニ 製造業者は、市場への出荷に係る業務が適正かつ円滑に実施されていることについて、製造販売業者による定期的な確認を受けなければなりません。
- あらかじめ、品質保証部門内で指定しておいた人に、上記に規定する定期的な確認と、その結果に関する記録を適正に行わせること。
- 製造業者が行う市場への出荷業務に関し、改善が必要な場合には、品質保証責任者に次の業務を行わせること。
- イ 当該製造業者に対して所要の措置を講じるよう文書により指示すること。
- ロ 当該製造業者に対して当該措置の実施結果の報告を求め、その報告を適正に評価し、必要に応じてその製造所を実地に確認し、その結果に関する記録を作成すること。
- ハ ロの評価及び確認の結果を総括製造販売責任者に対して文書により報告すること。
- 品質保証責任者以外の者に、上記2に規定する定期的な確認と記録の作成を行わせる場合、その者に、その結果を品質保証責任者に対して文書により報告させること。
適正な製造・品質管理の確保
品質保証部門のあらかじめ指定した者に、記録の作成や文書による報告を行わせなければなりません。
品質等に関する情報の収集・品質不良品の処理や回収
製造販売業者は、品質等に関する情報を得た場合、有効性や安全性への影響の評価や原因の究明を行わなければならず、これらは品質不良の恐れがある場合に実施しなければなりません。
製造販売業者が品質等に関する情報を得た時に、品質保証責任者が品質管理業務手順書等に基づいて実施しなければならない6つの業務は下記のとおりです。
- 当該品質情報を検討し、医薬品の品質、有効性及び安全性に与える影響並びに人の健康に与える影響を適正に評価すること。
- 当該品質情報に係る事項の原因を究明すること。
- 一と二の、評価又は究明の結果に基づき、品質管理業務又は製造業者等における製造管理及び品質管理に関し改善が必要な場合には、所要の措置を講じること。
- 一から三までの情報の内容、評価の結果、原因究明の結果及び改善措置を記載した記録を作成し、総括製造販売責任者に対して文書により速やかに報告すること。
- 二の究明又は三の改善措置のために、製造業者等に対し指示が必要な場合には、その指示を文書により行うとともに、製造業者等に対し文書による結果の報告を求め、それを適正に評価し、必要に応じてその製造所等の改善状況について実地に確認し、その結果に関する記録を作成すること。
- 当該品質情報のうち安全確保措置に関する情報を安全管理統括部門に遅滞なく文書で提供すること。
製造販売業者が、品質不良又はそのおそれが判明した場合、品質管理業務手順書等に基づいて、総括製造販売責任者及び品質保証責任者に行わせなければならない5つの業務は次の通りです。
- 品質保証責任者は、品質不良又はそのおそれに係る事項を速やかに総括製造販売責任者に対して報告し、それを記録すること。
- 総括製造販売責任者は、一に規定する報告を受けたときは、速やかに、危害発生防止等のため回収等の所要の措置を決定し、品質保証責任者及びその他関係する部門に指示すること。
- 品質保証責任者は、二の規定により総括製造販売責任者の指示を受けたときは、速やかに所要の措置を講じること。
- 品質保証責任者は、三の措置が適正かつ円滑に行われるよう、安全管理統括部門その他関係する部門との密接な連携を図ること。
- 品質保証責任者は、三の措置の実施の進捗状況及び結果について、総括製造販売責任者に対して文書により報告すること。
回収処理について
医薬品の製造販売業者は、医薬品の回収を行うとき、品質管理業務手順書等に基づいて、品質保証責任者に次に掲げる業務を行わせなければなりません。
- 回収した医薬品を区分して一定期間保管した後、適正に処理をしましょう。
- 回収の内容を記載した記録を作成して、医薬品等総括製造販売責任者に対して文書により報告しましょう。
自己点検について
医薬品の製造販売業者は、品質管理業務手順書等に基づき、あらかじめ指定した者に次に掲げる業務を行わせなければなりません。
- 品質管理業務について定期的に自己点検を行い、その結果の記録を作成。
- 品質保証責任者以外の者が当該業務を行う場合には、自己点検の結果を品質保証責任者に対して文書により報告すること。
医薬品の製造販売業者は、自己点検の結果に基づいて、改善が必要な場合には、品質保証責任者に所要の措置を講じさせた上で、その記録を作成させるとともに、医薬品等総括製造販売責任者に対して当該措置の結果を文書により報告させなければなりません。
教育訓練について
医薬品の製造販売業者は、あらかじめ指定した者に、品質管理業務に従事する者に対する教育訓練計画を作成させなければなりません。
医薬品の製造販売業者は、品質管理業務手順書及び前項に規定する教育訓練計画に基づき、あらかじめ指定した者に次に掲げる業務を行わせなければなりません。
- 品質管理業務に従事する者に対して、品質管理業務に関する教育訓練を計画的に実施し、その記録を作成すること。
- 品質保証責任者以外の者が当該業務を行う場合には、教育訓練の実施状況を品質保証責任者に対して文書により報告すること。
13.医薬品の貯蔵等の管理について(第15条)
製造に関する工程が全て終了した医薬品について、市場への出荷の可否判定を行います。
医薬品の製造販売業者が、その製造等をし、又は輸入した医薬品を製造販売の目的で貯蔵し、又は陳列する業務を行う場合には、次に掲げる事項を満たす必要があります。
- 当該業務に係る責任者を置くこと。
- 当該業務に従事する者(その責任者を含む。)は、次に掲げる事項を満たすこと。
- イ 品質保証部門に属する者でないこと。
- ロ 当該業務に必要な能力を有するとともに、必要な教育訓練を受けていること。
- 次に掲げる事項に適合する構造設備を医薬品等総括製造販売責任者が当該業務を行う事務所の所在地に有し、これを適正に維持管理すること。
- イ 医薬品を衛生的に、かつ、安全に保管するために必要な設備を有すること。
- ロ 作業を適正かつ円滑に行うために必要な面積を有すること。
- ハ 放射性医薬品を取り扱う場合には、薬局等構造設備規則(昭和三十六年厚生省令第二号)第一条第二項、第三項及び第四項に規定する構造設備を有すること。この場合において、同条第三項及び第四項中「調剤室」とあるのは「作業室」と読み替えるものとする。
- 医薬品の出納等当該業務に係る記録を作成すること。
文書や記録の管理
文書を作成・改訂した場合には、品質管理業務手順書に基づいてその文書の承認、配布、保存を行わなければなりません。
また、特定生物由来製品や人血液由来原料製品は有効期限30年、生物由来製品や細胞組織医薬品は有効期限10年、それ以外の医薬品の文書は5年または6年、教育訓練にかかるものは一律5年間の保存義務があります。
医薬品の製造販売業者は、この章に規定する文書及び記録については、次に掲げる事項に従い管理しなければなりません。
- 文書を作成し、又は改訂したときは、品質管理業務手順書に基づき、当該文書の承認、配布、保存等を行うこと。
- 品質管理業務手順書等を作成し、又は改訂したときは、当該品質管理業務手順書等にその日付を記載し、改訂に係る履歴を保存すること。
- この章に規定する文書及び記録については、作成の日(品質管理業務手順書等については使用しなくなった日。以下同じ。)から次に掲げる期間保存すること。
- イ 特定生物由来製品又は人の血液を原材料として製造される人血液由来原料製品にあっては、その有効期間に三十年を加算した期間
- ロ 法第二条第十項に規定する生物由来製品又は細胞組織医薬品(人血液由来原料製品を除く。)にあっては、その有効期間に十年を加算した期間
- ハ 生物由来製品又は細胞組織医薬品以外の医薬品にあっては、五年間(ただし、当該文書及び記録に係る医薬品の有効期間に一年を加算した期間が五年を超える場合には、有効期間に一年を加算した期間)
- ニ 教育訓練に係る文書及び記録については、イ、ロ、ハの規定に掲げる期間に関わらず五年間
まとめ
本記事では、GQPについて解説しました。
この記事を書いたのは
ヲタク行政書士®榊原沙奈です。