本記事では、GVPについて解説します。
Contents
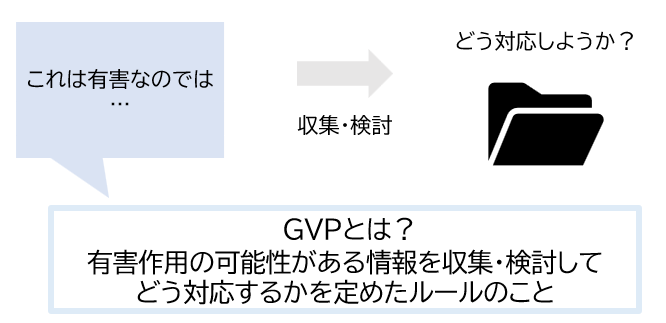
GVPとは
GVPは、医薬品の製造販売「後」における安全管理の基準です。
医薬品、医薬部外品、化粧品、医療機器の製造販売業者が、その品質、有効性、安全性に関する事項や適正な使用のために必要な情報(安全管理情報)を収集、検討し、その結果に基づいた必要な措置(製造販売後安全管理)について遵守すべき事項を定めたものをいいます。
GVPについて定められる「GVP省令」への適合は、製造販売業許可要件の1つで、許可の取得後も継続して遵守することが求められます。
GVPが必要な理由は?
GVP省令は、薬機法の目的を達成するための手段であり、患者を守る事を大きな目的としています。
適用条項
製造販売業者に適用されるのは、次の内容です。
- 総括製造販売責任者の業務について(第3条)
- 安全確保業務に係る組織及び職印について(第4条)
- 製造販売後安全管理業務手順書の作成(第5条)
- 安全管理責任者の業務(第6条)
- 情報収集(第7条)
- 検討、措置の立案(第8条)
- 実施(第9条)
- 市販直後調査(第10条)
- 自己点検(第11条)
- 教育訓練(第12条)
※製造販売業の区分により、適用を除外されるものもあります。
第三種に適用されるGVP省令
GVP省令第7、8,9条は、第一種に係る規定となっていますが、第三種は第15条にて準用されています。
第三種製造販売業者は、下記の内容を安全管理責任者に行わせなければなりません。
安全管理情報の収集(第7条)
- 医療関係者からの情報
- 学会報告、文献報告、その他研究報告に関する情報
- 厚生労働省その他の政府機関、都道府県、独立行政法人嫌宇品医療機器総合機構からの情報
- 外国政府、外国法人等からの情報
- 他の製造販売業者からの情報
- その他、安全管理情報
安全管理情報の検討および結果に基づく安全確保措置の立案(第8条)
- 7条で収集した安全管理情報を遅滞なく検討し、結果を記録すること
- 安全管管理情報について、「国内品質業務運営責任者が把握する必要がある」と認められる場合は、遅滞なく文書で提供すること
- 上記1で検討した結果、必要だと認めるときは、廃棄、回収、販売停止、添付文書の改訂、医薬情報担当者または医療機器情報担当者による医療関係者への情報提供、または厚生労働大臣への報告その他の安全確保措置を立案すること
- 3の規定で立案した安全確保措置の案(安全確保措置案)について、総括製造販売責任者に文書で報告して、写しを保存すること
安全確保措置の実施(第9条)
次の業務は「総括製造販売責任者」に行わせなければなりません。
- 安全確保措置案を適性に評価し、安全確保措置を決定し、それらの記録を作成、保存すること
- 安全確保措置を安全管理責任者に行わせる場合、その実施について文書で指示し、この文書を保存させること
- 安全確保措置を安全管理責任者以外の人に行わせる場合、その人に記録作成、文書での報告、写しを安全管理責任者に交付させること
- ここまでの規定に基づく報告を確認し、必要な措置を決定すること
GVP省令上の流れは?
安全管理情報を入手した際は、次の流れに従って確認し、対応を進めましょう。
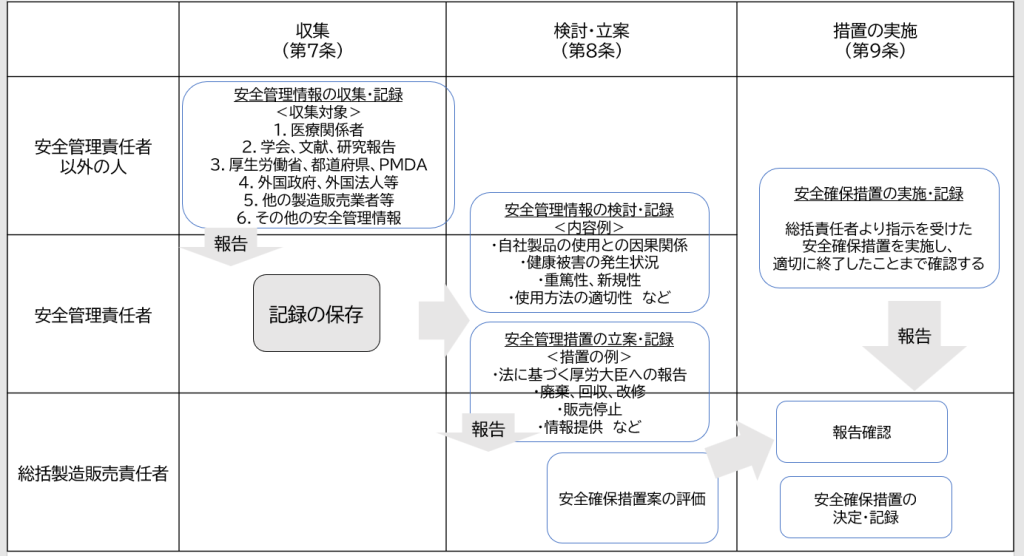
チェックすべきポイントは?
収集
- 入手した情報に健康被害に関する内容が含まれる場合、報告期限(15日または30日)を意識し、速やかに検討作業に移行する
- 担当者等が情報収集を行った場合、安全責任者に報告し、確認した記録を残す
検討・立案
- 収集した安全管理情報を遅滞なく検討する
- 正確な情報に基づいて検討が行う
- 国内品質業務運営責任者が把握する必要のある情報は、品責に速やかに文書で情報提供する
- 検討に必要な情報が不足している場合、追加調査を実施する
- 検討結果を記録する
- 措置が不要であると判断した場合、その判断に至る経緯について記録を作成
- 安全確保措置案を総責へ文書で報告する
- 当該製品だけでなく、自社の他製品についても同様の事象が生じる可能性がないかを確認する
措置の実施
- 総括製造販売責任者は、安全確保措置を評価、決定し、その記録を作成する
- 総括製造販売責任者は、安全確保措置の実施について、文書で指示する
- 措置の実施結果は、総括製造販売責任者に文書で報告する
- 総括製造販売責任者は、措置が適切に実施され終了したことを確認し、さらに必要な措置を決定する
どんな情報を収集するの?
GVP省令第7条の「安全管理情報の収集」について、収集方法は大きく2種類に分けられます。
- 販売先から寄せられる情報
- 自らが定期的に収集する情報
実際には、次のような情報の収集を行います。
- 医療関係者からの情報
- 自社が製造販売した医療機器が関与した健康被害に関する情報またはその恐れがある情報など
- 学会、文献その他研究報告に関する情報
- 国内外の学術雑誌等に掲載された研究報告や学会における研究発表
- 輸入先国業者、製造業者等、提携先企業から入手した研究報告
- 発表、未発表に関わらず、自社、関連企業において行われた研究報告 など
- 厚生労働省その他の政府機関、都道府県およびPMDAからの情報
- 厚生労働省からの通知、安全性情報
- 厚生労働省、都道府県、PMDAのホームページなど
- 外国政府、外国法人等からの情報
- 外国政府からの通知、安全性情報
- 外国政府などのホームページ
- 外国法人からの連絡 など
- 他の製造販売業者等からの情報
- 自社が製造販売する医療機器と同一、あるいは類似の医療機器について、他の製造販売業者、製造業者、販売業者、修理業者等から入手した情報 など
- その他の安全管理情報
- 消費者からの情報(自社の製品に対する苦情※や相談として入手した情報等)
- 業界団体からの情報
- 国民生活センターからの情報
- 自社製品の類似品に係る回収情報
- 自社の品質部門からの情報 など
不具合報告の期限
不具合報告期限をまとめると、下記の通りです。

安全確保措置の実施(第9条)の「確認」
安全管理責任者以外の担当者等が行う「安全確保措置の実施・記録」について、措置が適切に終了したことの確認を行わなければなりません。
ここでいう「確認」とは、次の内容を指します。
添付文書の「使用上の注意」を改訂した場合
- 指示したロットから新しい添付文書に差替えて出荷されたことを市場出荷判定者より報告を受け、確認する。
- 旧版の添付文書が誤って市場に出されることがないよう、適切に区画して保管後、廃棄されたことを確認
安全性の観点から「回収」した場合
- 回収対象製品の全ての出荷先に回収情報を周知し、適切に回収作業が終了したこと(使用済みの確認を含む)を確認する。
- 回収した製品が誤って市場に出されることがないよう、適切に区画して保管後、廃棄されたことを確認する。
※製品の品質不良ではないものの、安全性の観点から回収を行ったような場合、回収の実施は QMS の協力を得た場合でも、品責から報告を受ける等、最終的にGVPとして措置が適切に終了したことを確認し、総括製造販売責任者に報告する必要があります。
まとめ
本記事では、GVPについて解説しました。
この記事を書いたのは
ヲタク行政書士®榊原沙奈です。